HOME > 組織と研究者 > 公募研究概要「二次リンパ組織において記憶B細胞の時空間的制御を担う支持細胞の同定」
公募研究概要
二次リンパ組織において記憶B細胞の時空間的制御を担う支持細胞の同定
東京理科大学 生命医科学研究所 北村 大介
免疫記憶を担う記憶B細胞は主に胚中心において親和性成熟を経たB細胞から分化し、体内で長期に生存し、再び抗原と出会うと速やかにプラズマ細胞に分化して高親和性抗体を産生する。従来、記憶B細胞の存在は養子移入法により機能的に示されてきたが、近年では種々のマーカーを組み合わせてフローサイトメトリーにより同定可能となった。しかし、記憶B細胞特有のマーカーがなく、その数も僅少であるため、現状では記憶B細胞を高純度に単離したり、組織染色により特定することは困難である。よって、記憶B細胞の分化、長期生存、免疫応答に関わる因子や、それらが起こる場である微小環境についても何も分かっていない。私たちが独自に構築した培養系では、ナイーブB細胞から大量のIgG1+/IgE+の胚中心様B細胞(iGB細胞)を増殖させることができる。iGB細胞をマウスに移入するとIgG1+の記憶B細胞(iMB細胞)に分化し、脾臓では辺縁洞付近に局在し、長期に生存する。iMB細胞は2次移入先のマウスにおいて可溶性抗原に対し迅速な抗体産生を起こすので、機能的にも記憶B細胞と言える。iGB細胞には高率の遺伝子導入が可能で、マウスに移入すると多数のiMB細胞となるので、その免疫学的・組織学的・分子生物的解析が可能である。この実験系を利用し、本研究では記憶B細胞の分化、遊走・局在、生存、応答の制御に関わる分子を同定し、それらのリガンドを発現する支持細胞を同定することにより、記憶B細胞の時空間的動態を制御する微小環境の実体を明らかにすることを目標とする。
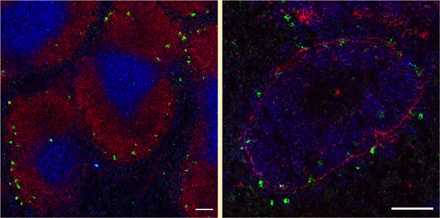
左図 赤:B220(B細胞濾胞) 青:Thy1(T細胞領域) 緑:抗原と結合したiMB細胞
右図 青:B220(B細胞濾胞) 赤:MAdCAM-1(辺縁洞) 緑:抗原と結合したiMB細胞
- Miyazaki A, Yogosawa S, Murakami A, Kitamura D.
Identification of CMTM7 as a Transmembrane Linker of BLNK and the B-cell Receptor.
PLoS One. 7:e31829 (2012) - Nojima T, Haniuda K, Moutai T, Matsudaira M, Mizokawa S, Shiratori I, Azuma T, Kitamura D.
In-vitro derived germinal centre B cells differentially generate memory B or plasma cells in vivo.
Nat Commun. 2:465 (2011) - Haniuda K, Nojima T, Ohyama K, Kitamura D.
Tolerance induction of IgG+ memory B cells by T-cell independent type II antigens.
J Immunol. 186:5620-5628 (2011)
本研究では手始めに、マイクロアレイのデータを手がかりに、記憶B細胞に選択的に発現する細胞膜表面蛋白を探索した。そのうち、gp49B(Lilrb4)がB細胞のなかで記憶B細胞と辺縁帯B細胞に選択的に発現していることを見出した。gp49B欠損マウスでは免疫後に形成される記憶B細胞の数は正常であったが、一次免疫後のIgM抗体および二次免疫後のIgMおよびIgG1抗体産生が亢進していた。さらに、In vitroの解析から、gp49BはIntegrin αvβ3と結合することにより、CD40からのErkを介したシグナルによる形質細胞分化を抑制することが分かった(Fukao et al. 2014)。近年、黒崎らは記憶B細胞が形質細胞に分化しやすい状態にプログラムされていることを明らかしたが(Kometani et al., Immunity 39:136, 2013)、記憶B細胞の微小環境は、gp49Bを介して記憶B細胞の形質細胞分化を常に制御していて、その過度の応答を防ぐ役割を担っていると考えられる。今後は、この微小環境の実体を明らかにしていきたい。
- Kitabatake, M., Soma, M., Zhang, T., Kuwahara, K., Fukushima, Y., Nojima, T., Kitamura, D., Sakaguchi, N.
JNK Regulatory Molecule G5PR Induces IgG Autoantibody-Producing Plasmablasts from Peritoneal B1a Cells.
J. Immunol. 194:1480-1488, 2015. - Wu, L., Parekh, V.V., Hsiao, J., Kitamura, D., Van Kaer, L.:
Spleen supports a pool of innate-like B cells in white adipose tissue that protects against obesity-associated insulin resistance. Proc.
Natl. Acad. Sci. USA 111: E4638-E4647, 2014. - Fukao, S., Haniuda, K., Nojima, T., Takai, T., Kitamura, D.
Gp49B-mediated negative regulation of antibody production by memory and marginal zone B cells.
J. Immunol. 193: 635-644, 2014. - Moutai, T., Yamana, H., Nojima, T., Kitamura, D.
A novel and effective cancer immunotherapy mouse model using antigen-specific B cells selected in vitro.
PLoS One 9: e92732, 2014. - Mizuta, R., Araki, S., Furukawa, M., Furukawa, Y., Ebara, S., Shiokawa, D., Hayashi, K., Tanuma, S., Kitamura, D.
DNase γ is the effector endonuclease for internucleosomal DNA fragmentation in necrosis.
PLoS One 8: e80223, 2013. - Caganova, M., Carrisi, C., Varano, G., Mainoldi, F., Zanardi, F., Germain, P.L., George, L., Alberghini, F., Ferrarini, L., Talukder, A.K., Ponzoni, M., Testa, G., Nojima, T., Doglioni, C., Kitamura, D., Toellner, K.M., Su, I.H., Casola, S.
Germinal center dysregulation by histone methyltransferase EZH2 promotes lymphomagenesis.
J. Clin. Invest. 123: 5009-5022, 2013.