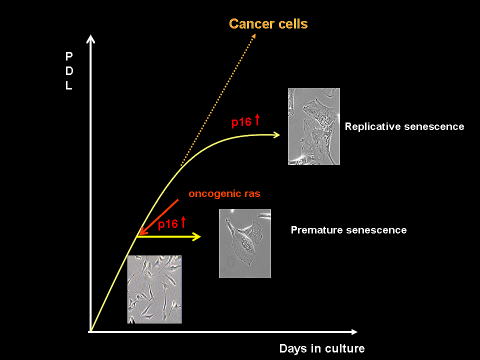
| 正常なヒトの体細胞は無限に増殖できるわけではなく、一定の回数分裂を繰り返した後に分裂寿命を迎え増殖を停止する(図−1)。この現象は細胞老化(cellular senescence)と呼ばれ、細胞分裂に伴うテロメア構造の変化に起因するDNAダメージや細胞分裂に伴う酸化的ストレスなど、細胞の内外から生じる様々なストレスにより引き起こされる現象であると考えられる。高齢者より採取した細胞は若い人より採取した細胞に比べ分裂可能回数が少ないことや、遺伝性早老症の患者より採取した細胞は同年齢の健常人より採取した細胞に比べ明らかに分裂可能回数が少ないことなどは、細胞老化が個体老化と密接な関係があることを示唆している。ここ数年の間に個体老化の進行を調節する働きを持つ遺伝子が次々に同定されたが、これらの多くが、ストレス制御やDNA修復など細胞老化と密接に関係していることからも細胞老化が個体老化の一因となっている可能性が考えられる。 |
|