|
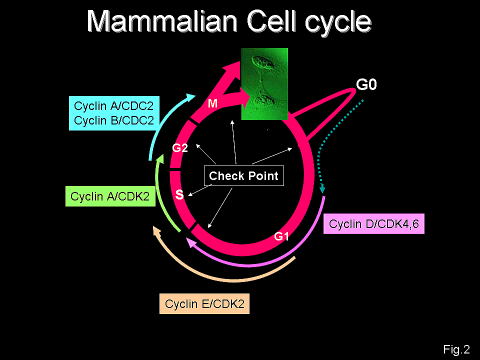
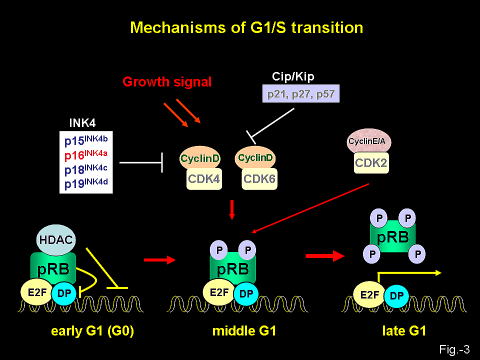
細胞周期の進行に最も重要な役割を担っているRBファミリー蛋白は主にサイクリン依存性キナーゼ(CDK)によるリン酸化によってその活性が制御(不活化)されています(図―2,3)。哺乳動物には7つのCDK阻害因子(CDKI)が知られており、RBファミリーを脱リン酸化状態に保つことによって活性化します。7つのCDKIのなかで、p16INK4a遺伝子のみが多くのヒトの癌において失活しており、癌抑制遺伝子として機能していることが知られています(図―3)。増殖能を有する正常な細胞においては通常p16INK4a遺伝子の発現は極めて低く、p16INK4aはほとんど機能していませんが、正常細胞が分裂寿命に達したり(Replicative
Senescence)、癌遺伝子の活性化など癌化の危険性がある異常なストレスが細胞に与えられた場合(Premature
Senescence)には、p16INK4a遺伝子の発現が著しく上昇し、不可逆的な増殖停止が起こることが明らかになりました。これらは正常細胞が有する癌化を防ぐための自己防御機構と考えられています。細胞老化の過程で如何にしてp16INK4a遺伝子の発現が誘導されるかについての分子メカニズムはほとんど未知でしたが、2001年に我々は転写因子であるEts1/2とその抑制因子であるId1によりp16INK4a遺伝子の発現が調節されていることを見いだしました(Ohtani et al., Nature, 2001) 。現在我々は細胞老化を誘導する様々なストレスシグナルにより、どのようにしてEts1/2やId1の活性が制御されているのか? また、Ets1/2やId1以外にどのような転写因子がp16INK4a 遺伝子発現誘導に関与しているかを培養細胞や遺伝子改変マウスを用いて調べています。原研究室ではp16INK4a 遺伝子発現誘導機構の解明により、得られた研究成果を将来、癌予防や癌治療に応用することを目標としています。
|