ヒト難病の原因遺伝子の発見
罹患率や死亡率が高く、臨床的に重要な疾患の多くは、今もその病因・病態が不明で、そのため根治が困難です。これらの疾患は、遺伝的要因と環境要因が複雑に絡み合って発症すると考えられており、GWAS
(genome wide association study)などの最先端の研究手法により、多くの遺伝子が発症に関与することが明らかになってきています。たとえばアトピー性皮膚炎の原因遺伝子に関しては、発症に関連する10個の遺伝子座が同定されていますが、これを合計してもアトピー性皮膚炎全体の14.4%を説明できるに過ぎず(Ref;
Ellinghaus et al, Nature Genet 45, 808, 2013)、疾患の全体像は未だ明らかになっていません。
ヒト疾患の病因と病態の解明にはさまざまなアプローチが存在しますが、そのひとつに単一遺伝子異常(メンデル病)に注目し、その原因遺伝子を明らかにし、それに基づいて病態を解明し、新規治療法を開発していく手法があります。たとえば、ノーベル医学・生理学賞を受賞したGoldsteinとBrownによる家族性高コレステロール血症の研究は、LDLレセプターの遺伝子変異がその原因であることを明らかにしました。本症の病態解析は、コレステロール代謝メカニズムの解明、さらには高コレステロール血症の治療薬スタチンの開発に結びつきました。この研究は、ヒト疾患の原因究明から新たな治療法開発を目指すDesease
Orientaed Researchの代表例です。
私たちは、小児科医として実際に症例を診療したアトピー性皮膚炎、高IgE血症、黄色ブドウ球菌による皮膚膿瘍と肺炎、骨粗鬆症、脊椎側彎症などを呈する『高IgE症候群』と呼ばれる遺伝性の難病に注目しました。
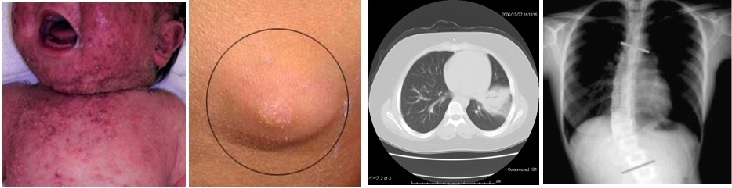
(図1)高IgE症候群の臨床症状
高IgE症候群においては、(左から右)新生児期に発症する重症アトピー性皮膚炎、発赤や熱感を欠く皮膚膿瘍(cold abscess)、黄色ブドウ球菌による肺炎、脊椎側彎症等を認める。
本症候群は1966年に第1例が報告されその症状が臨床的に重要な多くの疾患を含むことより多くの研究がなされていましたが、病因・病態はまったく明らかになっていませんでした。私たちは、本症患児の免疫能を詳細に検討することにより、チロシンキナーゼ
TYK2の欠損により一部の高IgE症候群が発症し、さらにSTAT3のドミナントネガティブ(dominant negative; DN)変異がその主要な原因であることを見出しました(Minegishi
et al. Nature 448, 1058, 2007)。
ヒト難病のモデルマウスの確立
高IgE症候群における各種病態の形成メカニズムを明らかにするために、Stat3-DN変異体を発現するモデルマウスを作成しました。STAT3の機能低下はES細胞のLIFのシグナルを抑制して、germline
transmissionを阻害すると考えられたため、野生型STAT3をネオマイシン耐性遺伝子と共にloxP配列で挟み、その下流にヒトで高頻度で見られたSTAT3-DN変異を配置することにより、この問題を解決しました。このStat3-DN-floxマウスを卵細胞特異的にCre
recombinaseを発現するマウス(ZP3-Creマウス)の雌と交配し、全身にStat3-DNを発現するマウスを作製しました。これまでの実験結果で、Stat3-DNを全身に発現するマウスでは、野生型マウスと比較して血清IgEレベルが100倍以上に上昇し、IL-17の産生も低下し、黄色ブドウ球菌感染症を自然発症することが判ってきました。このことから、マウスにおいてもヒトと同様にSTAT3-DNの発現は、高IgE症候群の症状を引き起こすことが明らかになりました。
この疾患モデルマウスを用いて、アトピー性皮膚炎、高IgE血症、黄色ブドウ球菌感染症、骨粗鬆症などの発症メカニズムを分子レベルで明らかにしていきます。さらに、ヒトとマウスの間には遺伝子機能や治療に対する反応に種差がある可能性が考えられるため、ヒトにおいても同様の疾患発症の分子メカニズムが存在しているかどうかを確認し、新規診断法・治療法の開発へと研究を展開していきます。

