T細胞分化におけるチェックポイント(高田健介&高浜洋介;先端医学社「炎症と免疫」 2014年)
はじめに
T細胞は骨髄の造血幹細胞に由来し、胸腺での分化の過程で自己と非自己を識別し抗原特異的に活性化する獲得免疫系に固有の能力を獲得する。胸腺は大きく皮質と髄質から構成され、皮質には多くの未熟な胸腺細胞(T細胞系列の胸腺内細胞)が、髄質にはより成熟した胸腺細胞が存在する。これらの胸腺細胞は胸腺内を次々に移動しながら、それぞれの微小環境に特有の上皮細胞や樹状細胞と相互作用する。その過程で、多様な抗原受容遺伝子を発現する細胞集団がひとまず作り出された後、生体にとって有用で、かつ自己に寛容な細胞だけが選択され生存することを許可されるという多段階のチェックポイントを通過する。本稿では、成熟T細胞集団が完成するまでの胸腺内のチェック機構について解説する。
1. 胸腺皮質におけるT前駆細胞の初期分化
骨髄で産生されたT前駆細胞は、皮質髄質境界領域に豊富に存在する血管を介して胸腺へと移入する。これには胸腺の血管内皮細胞が発現する接着因子(P-selectin)、上皮細胞が発現するケモカイン(CCL21、CCL25)の関与が知られている(1-4)。移入後の前駆細胞は胸腺皮質上皮細胞が産生するIL-7 とDelta-like 4 (Dll4)の刺激によって増殖するとともにT細胞系列への分化を開始する(5-7)。このとき、RAG(recombination activating gene)の働きによってTCRβ遺伝子のVDJ領域に遺伝子再構成が生じ、個々の細胞が異なるTCRβ鎖遺伝子を保有するようになる(図1)。遺伝子再構成の結果、適切なコドンフレームをもち全長TCRβ鎖を発現できた胸腺細胞では、TCRβ鎖と代替α鎖(pre-TCRα: pTα)が会合してpre-TCRが細胞膜上に発現される。pre-TCRの細胞表面への発現は、リガンド刺激なしにシグナルを誘起し、対立遺伝子座の再構成を阻害する(8)。また、pre-TCRシグナルによって共刺激分子であるCD4やCD8の発現およびTCRα遺伝子VJ領域の遺伝子再構成が誘導され、αβTCRを細胞表面に発現するCD4+CD8+(double positive: DP)胸腺細胞への分化が進行する(図1)。pre-TCR依存的に分化が誘導されるこのチェックポイントはβ選択と呼ばれる。
2. 胸腺皮質における正の選択
TCR遺伝子の再構成によって作り出されたTCRを発現するDP胸腺細胞集団の中には、自己MHCを認識できず使い物にならない細胞や、自己成分に対して強い反応を示す有害な細胞が含まれる。そのため、これらの細胞を排除して有用な細胞だけを選択的に分化させる機構が存在する(図2)。DP胸腺細胞はまず、自身が発現するTCRと胸腺皮質上皮細胞(cortical thymic epithelial cell: cTEC)に提示された自己ペプチド-MHC複合体(self-peptide-MHC complex: spMHC)との相互作用を介して、リガンドに対して低い親和性をもった細胞のみが生存および分化のシグナルを受ける(9,10)。このチェックポイントを正の選択(positive selection)と呼ぶ。一方、親和性が低すぎたり高すぎる細胞は死滅する。
cTECには、正の選択を誘導する自己ペプチドを産生するための特殊な抗原プロセシング機構が存在することが近年明らかになってきている(図3)。プロテアソームは細胞質内タンパク質を分解しMHCクラスI会合ペプチドを産生するが、β5t構成鎖を含む胸腺プロテアソームはcTEC特異的に発現され、CD8+T細胞のレパトア形成に必要なペプチドの産生を担う(11,12)。胸腺プロテアソーム特有のプロテアーゼ活性がどのような自己ペプチドを産生し、効率的に正の選択を誘導するのかは分かっていない(13)。一方、cTECのリソソームに豊富に存在するcathepsin Lやthymus-specific serin protease(TSSP)はMHCクラスII会合ペプチドを産生することで、CD4+T細胞の正の選択に関与する(14-16)。また、通常はストレスや飢餓状態にさらされた細胞で生じるオートファジー(autophagy)が、cTECの多くでは恒常的に活性化されており、内因性抗原がオートファゴソームを介してリソソームに運搬されることが知られている (17)。
3. 胸腺髄質における負の選択
胸腺皮質で正の選択を受けて生存したDP胸腺細胞はCD4+CD8-あるいはCD4-CD8+ (single positive: SP)胸腺細胞へと分化誘導される(図1)とともにCCR7を発現し、そのリガンドであるCCL19およびCCL21が豊富に発現される胸腺髄質へと移動する(18,19)(図3)。髄質では、胸腺髄質上皮細胞(mTEC)や樹状細胞に提示されたspMHCに対して高い親和性をもつ細胞がアポトーシスにより排除される(20)(図2)。このチェックポイントを負の選択(negative selection)と呼び、中枢性自己寛容の確立に必須である。mTECではゲノム上のすべての遺伝子を低レベルで発現する無差別遺伝子発現(promiscuous gene expression)が恒常的に生じているために、胸腺外のさまざまな臓器に特異的に発現される抗原(tissue-specific antigen: TSA)に対しても自己寛容を確立させることができる(21)。Aire(autoimmune regulator)は無差別遺伝子発現を制御する核内因子であり、その欠損は自己免疫疾患を引き起こす (22)。また、胸腺髄質は制御性T細胞(Treg)の分化の場としても自己寛容に貢献する(23)。spMHCとの親和性が比較的強く、かつ負の選択の閾値を下回る細胞がTregに分化すると考えられている(図2)(24-26)。Tregの分化には、spMHCを認識することによるTCRシグナルに加えて、CD28やOX40、GITRなどのTNF受容体スーパーファミリーを介した共刺激、TGF-βやIL-2などのサイトカインが必要とされる (27-29)。以上記してきた多段階のチェックポイントを経て髄質で成熟した胸腺細胞は、スフィンゴシン1リン酸受容体1(sphingosine 1-phosphate receptor 1: S1P1)を発現し、血中のリガンド(S1P)に誘引されて胸腺から移出する(図3)(30)。
4. 正および負の選択を起こすTCRシグナル
spMHCを認識することで惹起されるTCRシグナルは、その親和性の違いによって、生と死という真逆の運命を胸腺細胞にもたらす。TCRとspMHCとの親和性は結合時間に反映され、親和性が高いほど解離しにくい(31)。この違いは下流で活性化されるMAPK経路の違いとして現れる (32)。正の選択には、低親和性ペプチドの結合によってもたらされるLATの部分的なリン酸化とそれに続くRasを介した弱く持続的なERKの活性化が関与する (33-37)。一方、高親和性ペプチドによる負の選択ではLATは完全にリン酸化され、Grb2やSOSを介したJNKや p38キナーゼの活性化を引き起こす(38-39)。様々な強度のTCRシグナルが正の選択と負の選択という対極の結果に帰結する機構として、最近、中程度の親和性をもったペプチドで惹起されるTCRシグナルの強度を特異的に減弱させることで正の選択を促すThemis(thymocyte-expressed molecule involved in selection)の関与が示唆されている(40)。
おわりに
TCR遺伝子の再構成によって作られた初期の胸腺細胞集団から、生体に有用な細胞だけが胸腺内で選択され成熟T細胞となり全身のリンパ組織へ供給される。胸腺細胞の選択はspMHCとの相互作用によってもたらされるTCRシグナルに依存する。最近の研究から胸腺上皮細胞が独自の機構によって胸腺微小環境固有の自己ペプチドを作りだすことが明らかとなってきた。今後、胸腺細胞の選択を引き起こす自己ペプチドの実体が解明されることで、T細胞分化におけるチェックポイントの実像がよりくっきりと見えてくるのではないだろうか。
参考文献
1. Rossi FM et al: Recruitment of adult thymic progenitors is regulated by P-selectin and its ligand PSGL-1. Nat Immunol 91:626-634, 2005
2. Liu C et al: Coordination between CCR7- and CCR9-mediated chemokine signals in prevascular fetal thymus colonization. Blood 108:2531-2539, 2006
3. Zlotoff DA et al: CCR7 and CCR9 together recruit hematopoietic progenitors to the adult thymus. Blood 115:1897-905, 2010
4. Krueger A et al: CC chemokine receptor 7 and 9 double-deficient hematopoietic progenitors are severely impaired in seeding the adult thymus. Blood 115:1906-1912, 2010
5. Peschon JJ et al: Early lymphocyte expansion is severely impaired in interleukin 7 receptor-deficient mice. J Exp Med 180:1955-1960, 1994
6. Hozumi K et al: Delta-like 4 is indispensable in thymic environment specific for T cell development. J Exp Med 205:2507-2513, 2008
7. Koch U et al: Delta-like 4 is the essential, nonredundant ligand for Notch1 during thymic T cell lineage commitment. J Exp Med 205:2515-2523, 2008
8. Yamasaki S et al: Molecular basis for pre-TCR-mediated autonomous signaling. Trends Immunol 28:39-43, 2007
9. Laufer TM et al: Unopposed positive selection and autoreactivity in mice expressing class II MHC only on thymic cortex. Nature 383:81-85, 1996
10. Daniels MA et al: Thymic selection threshold defined by compartmentalization of Ras/MAPK signalling. Nature 444:724-729, 2006
11. Murata S et al: Regulation of CD8+ T cell development by thymus-specific proteasomes. Science 316:1349-1353, 2007
12. Nitta T et al: Thymoproteasome shapes immunocompetent repertoire of CD8+ T cells. Immunity 32:29-40, 2010
13. Xing Y et al: Thymoproteasome subunit-β5T generates peptide-MHC complexes specialized for positive selection. Proc Natl Acad Sci U S A 110:6979-6984, 2013
14. Nakagawa T et al: Cathepsin L: critical role in Ii degradation and CD4 T cell selection in the thymus. Science 280:450-453, 1998
15. Honey K et al: Cathepsin L regulates CD4+ T cell selection independently of its effect on invariant chain: a role in the generation of positively selecting peptide ligands. J Exp Med 195:1349-1358, 2002
16. Viret C et al: Thymus-specific serine protease contributes to the diversification of the functional endogenous CD4 T cell receptor repertoire. J Exp Med 208:3-11, 2011
17. Nedjic J et al: Autophagy in thymic epithelium shapes the T-cell repertoire and is essential for tolerance. Nature 455:396-400, 2008
18. Ueno T et al: CCR7 signals are essential for cortex-medulla migration of developing thymocytes. J Exp Med 200:493-505, 2004
19. Kurobe H et al: CCR7-dependent cortex-to-medulla migration of positively selected thymocytes is essential for establishing central tolerance. Immunity 24:165-177, 2006
20. Hogquist KA et al: Central tolerance: learning self-control in the thymus. Nat Rev Immunol 5:772-782, 2005
21. Derbinski J et al: Promiscuous gene expression in medullary thymic epithelial cells mirrors the peripheral self. Nat Immunol 2:1032-1039, 2001
22. Anderson MS et al: Projection of an immunological self shadow within the thymus by the aire protein. Science 298:1395-401, 2002
23. Cowan JE et al: The thymic medulla is required for Foxp3+ regulatory but not conventional CD4+ thymocyte development. J Exp Med 210:675-681, 2013
24. Jordan MS et al: Thymic selection of CD4+CD25+ regulatory T cells induced by an agonist self-peptide. Nat Immunol 2:301-306, 2001
25. Hsieh CS et al: An intersection between the self-reactive regulatory and nonregulatory T cell receptor repertoires. Nat Immunol 7:401-410, 2006
26. Moran AE et al: T cell receptor signal strength in Treg and iNKT cell development demonstrated by a novel fluorescent reporter mouse. J Exp Med 208:1279-1289, 2011
27. Salomon B et al: B7/CD28 costimulation is essential for the homeostasis of the CD4+CD25+ immunoregulatory T cells that control autoimmune diabetes. Immunity 12:431-440, 2000
28. Ouyang W et al: Transforming growth factor-beta signaling curbs thymic negative selection promoting regulatory T cell development. Immunity 32:642-653,2010
29. Mahmud SA et al: Costimulation via the tumor-necrosis factor receptor superfamily couples TCR signal strength to the thymic differentiation of regulatory T cells. Nat Immunol 15:473-481,2014
30. Matloubian M et al: Lymphocyte egress from thymus and peripheral lymphoid organs is dependent on S1P receptor 1. Nature 427:355-360, 2004
31. Palmer E et al: Affinity threshold for thymic selection through a T-cell receptor-co-receptor zipper. Nat Rev Immunol 9:207-213, 2009
32. Teixeiro E et al: ERK and cell death: ERK location and T cell selection. FEBS J 277: 30-38, 2010
33. Swan KA et al: Involvement of p21ras distinguishes positive and negative selection in thymocytes. EMBO J 14:276-285, 1995
34. McNeil LK et al: A requirement for sustained ERK signaling during thymocyte positive selection in vivo. Proc Natl Acad Sci U S A 102:13574-13579, 2005
35. Starr TK et al: Positive and negative selection of T cells. Annu Rev Immunol 21:139-176, 2003
36. Rincón M et al: The JNK pathway regulates the In vivo deletion of immature CD4+CD8+ thymocytes. J Exp Med 188:1817-1830, 1998
37. Sugawara T et al: Differential roles of ERK and p38 MAP kinase pathways in positive and negative selection of T lymphocytes. Immunity 9:565-574, 1998
38. Gong Q et al: Disruption of T cell signaling networks and development by Grb2 haploid insufficiency. Nat Immunol 2:29-36, 2001
39. Sabapathy K et al: c-Jun NH2-terminal kinase (JNK)1 and JNK2 have similar and stage-dependent roles in regulating T cell apoptosis and proliferation. J Exp Med 193:317-328, 2001
40. Fu G et al: Themis sets the signal threshold for positive and negative selection in T-cell development. Nature 504:441-445, 2013
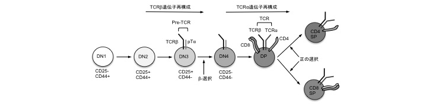
図1 胸腺細胞の成熟過程
胸腺細胞は分化の進行に伴って、CD4およびCD8の発現を変化させる。幼若な胸腺細胞はCD4およびCD8を両方とも発現せず(double negative: DN)、DN細胞はさらにCD25とCD44の発現によってDN1からDN4に分類される。DN2からDN3にかけてTCRβ遺伝子の再構成が生じ、TCRβとpTα(pre-TCRα)からなるpre-TCRが細胞表面に発現されることでβ選択が誘導される。このシグナルによってTCRβ遺伝子の再構成は停止され、CD4およびCD8の両方を発現したDP(double positive)細胞への分化およびTCRα遺伝子の再構成が誘導される。TCRαとTCRβから構成されたTCRとspMHCとの弱い相互作用によりDP胸腺細胞は正の選択を受けてTCRα遺伝子の遺伝子再構成を停止するとともに、CD4あるいはCD8のどちらかを発現するSP(single positive)細胞へと分化する。
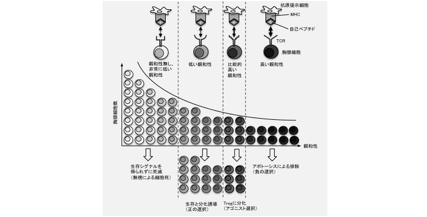
図2 自己ペプチド-MHC複合体(self-peptide-MHC complex: spMHC)との親和性に依存した胸腺細胞の選択
TCRとspMHCの親和性は、胸腺細胞の運命を決定づける。親和性が全くないか、あるいは非常に低い細胞は生存シグナルを受けられずに死滅する(無視による細胞死、death by neglect)。ほとんどの胸腺細胞はこの運命をたどる。細胞がspMHCに対して親和性の低いTCRを発現している場合には、生存と分化が誘導される(正の選択)。一方、親和性が高い場合にはアポトーシスが誘導されて排除されるが(負の選択)、そのなかでも比較的親和性の低い細胞はTregに分化する(アゴニスト選択)。
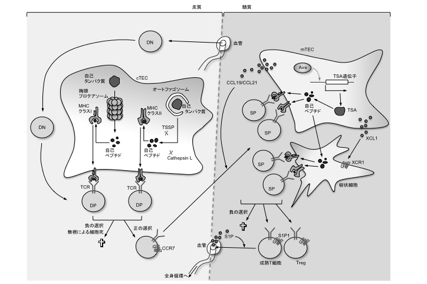
図3 T細胞の分化と選択を司る胸腺内微小環境
皮質髄質境界領域の血管から移入したT前駆細胞は、皮質においてDN細胞からDP細胞へと分化する。cTECに発現されるspMHCとの親和性によってDP細胞の生死が決定される。cTECに特異的に存在する胸腺プロテアソームは、細胞質内の自己タンパク質を分解してMHCクラスIに提示される自己ペプチドを産生し、CD8+T細胞の正の選択に不可欠な役割を果たす。同様に、自己タンパク質がオートファジーを介してリソソームへ運ばれると、cathepsin LやTSSPなどのプロテアーゼによって分解され、その結果産生された自己ペプチドはMHCクラスIIに会合してCD4+T細胞の正の選択を誘導する。正の選択の際に惹起されたTCRシグナルによって、SP細胞への分化とともにCCR7の発現が誘導され、胸腺細胞はmTECが産生するリガンドケモカイン(CCL19およびCCL21)に誘引されて髄質へ移動する。mTECには核内因子であるAireが発現されており、TSAの発現を担う。TSA由来の自己ペプチドはmTEC上のMHCに直接提示されるか、あるいはDCに取り込まれたのちに提示される。このspMHCに高い親和性を持つSP胸腺細胞は負の選択により排除されるか、Tregに分化することで中枢性自己寛容が確立される。成熟したT細胞は走遊因子S1P に対する受容体S1P1を発現し、S1Pが豊富に存在する血流中に放出される。
ニュースのページに戻る


